04米の機能性超硬質米による糖尿病・認知症予防の可能性
1超硬質米とは
(1)糖尿病と認知症
国際糖尿病連合によると、世界の糖尿病人口は5億3,700万人。成人の10人に1人が糖尿病に罹患していることになります※1。世界疾病負担研究2019によると、世界の認知症患者数は、2019年の5,700万人から2050年には1億5,280万人へと約3倍に増加するということです※2。また、九州大学の久山町における疫学研究では、糖尿病患者の認知症発症率は健常者の約2倍と報告されています※3。
わが国は超高齢社会となり、糖尿病や認知症が増加しているため、医薬研究に加えて、「食による予防」が必要となっています。
(2)超硬質米はアミロペクチン長鎖の多い米
食後血糖上昇の少ない低GI食品は、インスリン抵抗性の発生抑制による糖尿病予防に有望とされており、米における食後血糖上昇の抑制に関しては、従来、高アミロース米が重視されてきました。
超硬質米とは、九州大学の佐藤らが化学的突然変異によって作出した米であり、でんぷん枝作り酵素の欠失によりアミロペクチン短鎖が少なくて中長鎖が多く、見かけのアミロース含量がきわめて高い米の総称です。大坪らは、佐藤らと共同で超硬質米EM10の特性評価および利用適性に関する研究を行ってきました※4。超硬質米については、久保晶子ら※5や藤田直子ら※6、山口 修ら※7および野呂 渉ら※8も研究を行っています。これらの研究から、高アミロース米や超硬質米の米飯の場合は、食後血糖上昇が緩やかとなり、2型糖尿病の発症予防に役立つ可能性が示されています。
(3)認知症と研究の目的
認知症のうちでもっとも多いのはアルツハイマー病です。その発症機構についてまだ定説はありませんが、池内らは、アミロイドβやタウタンパク質が同病を特徴づける中核病理所見であることから、同病の生化学マーカーとして、髄液中のアミロイドβ42低下、リン酸化タウ上昇などが適切であり※9、また、同病の発症にインスリン神経伝達機構が関与していることなどを報告しています※10。
大坪らはこの仮説に従い、超硬質米によって糖尿病発症を抑制しながら、黒米の抗酸化性によってアルツハイマー病の発症抑制効果をさらに高めることを試みました。研究では、上記の仮説および研究成果をもとに、アミロペクチン長鎖型の超硬質米と黒米を配合し、糖尿病および認知症の複合予防効果の期待される加工米飯を開発することを目的としました。
本稿では、筆者らの既報論文※11※12をもとに解説します。
2試料および実験方法
1)原料米
アミロペクチン長鎖型の超硬質米「新潟129号」、うるち黒米「おくのむらさき」、一般米「コシヒカリ」を使用しました。
2)評価方法
中村らは、試料米および当該米飯の水溶性および脂溶性の抗酸化性(HORAC値およびLORAC値)、ラピッドビスコアナライザーにより糊化特性、テンシプレッサー(バルク法)により米飯物性等を評価しました。
3)試 料
前述1)の3種類の試料米を4:4:2に配合し、黒米ぬか(2.5%)と米油(0.3%)を添加して200MPa、5分間の高圧処理を施し、無菌米飯に調製して試験米飯としました。市販コシヒカリ白米の無菌米飯を対照米飯としました。
4)試験方法
新潟バイオリサーチパークヒト試験倫理委員会の承認を得て12名ずつの並行2群間試験(12週間毎日1食摂取)を実施しました。試験開始時と12週間後にCognitraxによる認知機能試験を行い、12週間後に単回投与による食後の血糖・インスリン変動を測定しました。
3研究結果
新潟129号は他の品種と比較して、アミロース含量、難消化性でんぷん含量、食物繊維含量が有意に高い値を示しました。黒米はアントシアニンを含み、強い抗酸化性を示しました。
(1)試料の調製と評価
1)試験米飯の調製
抗酸化性の強い黒米玄米、難消化性の超硬質米玄米、一般米コシヒカリ玄米を4:4:2の割合で配合し、黒米ぬかと米油を添加して密封し、200MPaの高圧処理の後、無菌包装米飯を調製して試験米飯とし、市販のコシヒカリ白米の高圧処理無菌包装米飯を対照米飯としました。
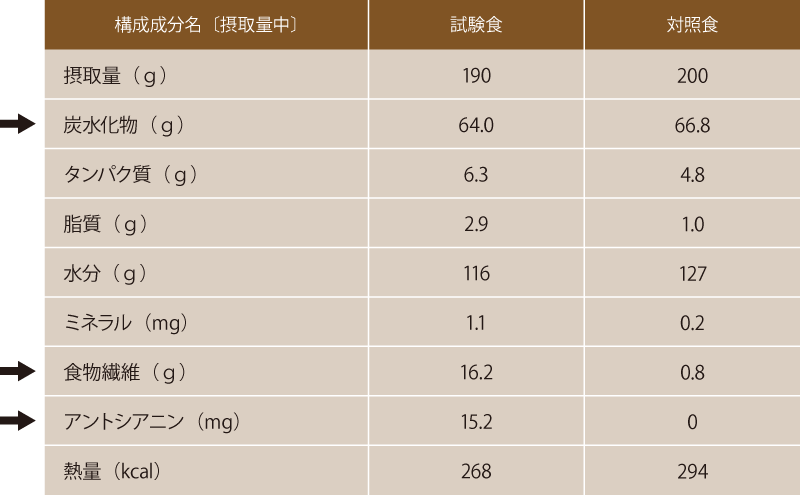
試験米飯および対照米飯は、炭水化物含量が摂取量中約65gになるように製造しました。試験米飯は、16.2gの食物繊維、15.2mgのアントシアニン色素を含み、対照米飯に比べて有意に高い酸素ラジカル吸収能(ORAC値)を示しました(図表1)。
図表1 試験食および対照食の成分組成
2)評価方法
ヒト試験では、24名の被験者をミニメンタルステート(MMSE)試験で均等に2群に割り付け、毎日1食を12週間継続摂食し、試験開始時と終了時の認知機能をCognitraxによって評価しました。
被験者2群では、肥満度の指標であるBMI(body mass index)、空腹時血糖、HbA1c(hemoglobin A1c)、MMSE(mini-mental state examination)試験結果のいずれにおいても有意差が認められず、同等でした。
(2)研究結果
1)インスリン濃度変化
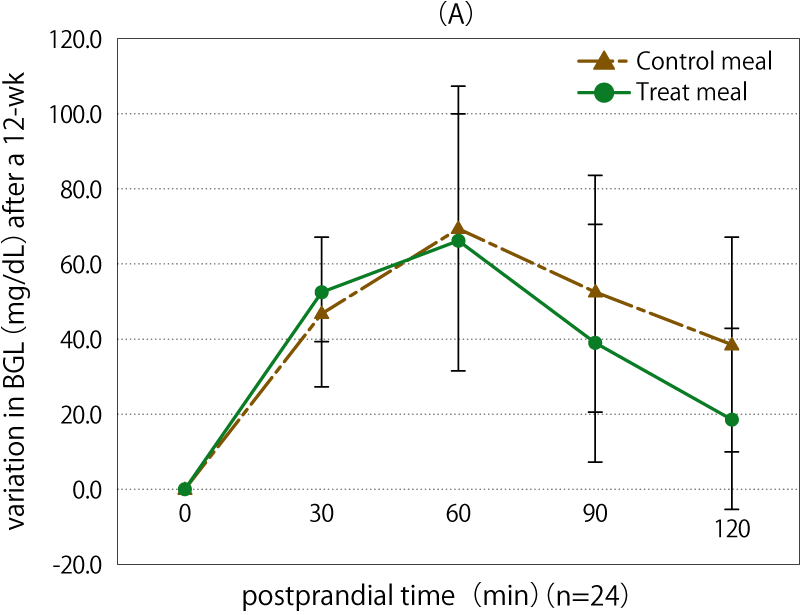
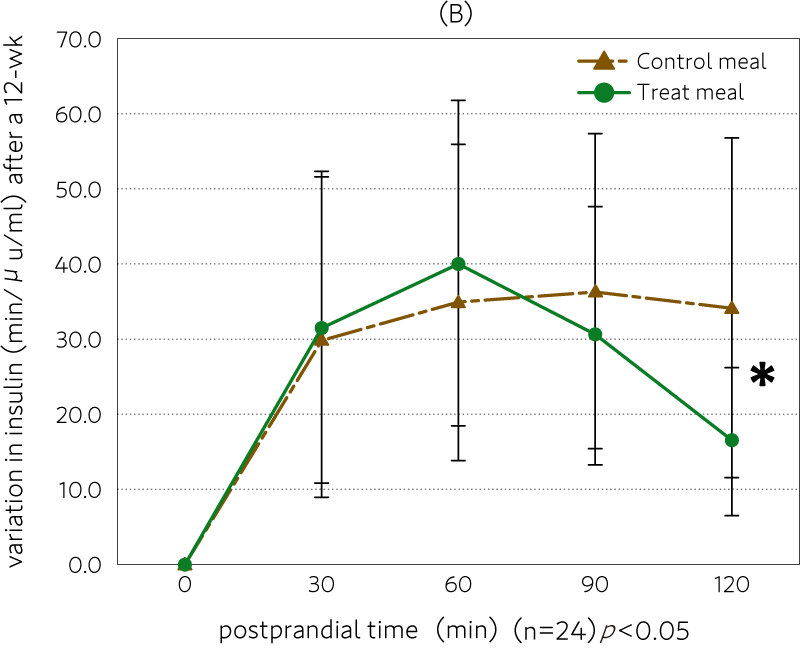
12週間後の血糖値とインスリン濃度の変化を図表2に示します。(A)に示した血糖値の変化では、試験食群と対照食群の間に有意差は示されませんでしたが、試験食の方がやや低い傾向が認められました。(B)に示したインスリン値においては、120分後に有意に試験食群が対照食群に比べ低下しました(p < 0.05)。
インスリンは、脳の糖エネルギー代謝を調整するほかに、神経伝達やシナプスの可塑性にも作用します。インスリンは、脳血管関門を介して脳内に輸送されますが、高インスリン血症では、脳へのインスリンの移行が低下するため、脳におけるこれらのインスリン作用が低下し、神経保護的作用が減弱すると報告されています。
図表2 12週間後の血糖値とインスリン濃度の変化
2)認知機能の比較
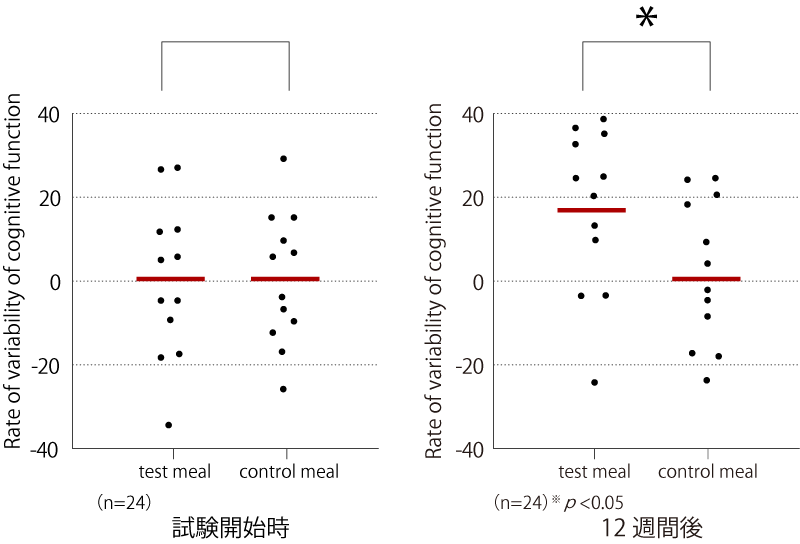
認知機能検査における言語記憶能力の改善効果を図表3に示します。認知機能に関するCognitrax試験の結果、12週間後の試験食群は、対照食群に比べて、危険率5%で有意な言語記憶能力の改善を示しました。
また、指たたきテスト(左手)も危険率5%で有意の改善効果が認められ、有意差は認められなかったものの、SCDテストにおける誤答減少およびストループテストにおける単純反応時間の減少についても、危険率10%の改善傾向が認められました。
図表3 認知機能検査における言語記憶能力の改善効果
4超硬質米の有用性
(1)考 察
試験米飯は、超硬質米に起因する難消化性を示し、摂食後のインスリン分泌が有意に低いことが示されました。このことから、試験米飯は、脳中のインスリン濃度を確保できる可能性が考えられます。
また、黒米のアントシアニン色素による抗酸化性およびβ-セクレターゼ阻害活性も、認知機能の改善に有効と期待されます。
12週間のヒト試験において、試験食に起因する有害事象は認められず、12名の被験者全員が試験を完了したことから、本試験米飯は、毎日食べる機能性食品としての実用化が有望と考えられます。
(2)結 論
試料米の超硬質米は、アミロペクチン長鎖型で難消化性が強く、摂食後のインスリン分泌が有意に低いことが示されました。また、黒米のアントシアニン色素による抗酸化性およびβ-セクレターゼ阻害活性も、認知機能の改善に有効と期待されます。
本試験食による12週間のヒト試験において、インスリン分泌の抑制効果および言語記憶能力の改善効果が立証されました。試験食に起因する有害事象は認められず、12名の被験者全員が試験を完了したことから、本試験米飯は、毎日食べる複合機能性食品としての実用化が有望と考えられます。
本稿では、超硬質米と黒米による認知症・糖尿病複合予防の可能性について解説した。このほかに、渡邊らは、腎臓病患者向けの低タンパク質玄米の開発に成功しており※13、各種の米加工品による健康機能の維持増進の可能性が期待されている。
倫理的配慮および謝辞
本研究に関し、利益相反はありません。ヒト臨床試験は、新潟バイオリサーチパーク倫理委員会承認とUMIN登録(000044767)後に実施しました。研究予算支援を頂いた生研センター、ヒト試験を委託した新潟バイオリサーチパーク㈱およびイソアミラーゼを提供頂いた㈱林原に感謝いたします。
参考文献
- IDF Diabetes Atlas, 10th edition 2021.
https://diabetesatlas.org/atlas/tenth-edition/[外部リンク](2022年9月5日閲覧) - GBD 2019 Dementia Forecasting Collaborators“Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050”an analysis for the Global Burden of Disease Study 2019. ”DOI:
https://doi.org/10.1016/S2468-2667(21)00249-8[外部リンク](Published:January 06, 2022年9月5日閲覧) - Kawamura K, Umemura T, Hotta N“Cognitive impairment in diabetic patients. Can diabetic control prevent cognitive decline?”J. Diabetes Investig 18:413–423(2012)
- 高橋 仁ほか「高アミロース突然変異米の用途推定のための基本品質特性評価」食科工48:617-621(2001)
- Kubo A et al“Structure, physical, and digestive properties of starch from wx ae double-mutant rice.”J Agric Food Chem. 58:4463-4469(2010)doi:10.1021/jf904074k.
- Takahashi T and Fujita N“Thermal and rheological characteristics of mutant rice starches with widespread variation of amylose content and amylopectin structure.”Food Hydrocolloids. 62:83-93(2017)
- 山口 修ほか「レジスタントスターチ含量の高い米粉用水稲品種「ちくし粉85号」の育成」福岡県農林業総合試験場研究報告 4:33-40(2018)
- Noro W et al“Characterization of the New Amylopectin Long-chain Rice Cultivar Chou 2418 and Its Boiled Rice Grains.”Food Sci Technol Res. 25:227-235(2019)
- 池内 健・西澤正豊「遺伝子と生化学バイオマーカー」最新医学66巻:80-90(2011)
- Tokutake, T et al“Hyperphosphorylation of Tau induced by naturally secreted amyloid-β at nanomolar concentrations is modulated by insulin-dependent AKt-GSK3β signaling pathway.” J Biol Chem. 287:35222-35233(2012)
- 大坪研一・中村澄子「糖尿病および認知症の複合予防効果の期待される米飯および米加工食品開発の取り組み」生物工学97:610-615(2019)
- Nakamura, S et al.“Possibility for Prevention of Type 2 Diabetes Mellitus and Dementia Using Three Kinds of Brown Rice Blends after High-Pressure Treatment.”Foods 11:818(2022)
https://doi.org/10.3390/foods11060818[外部リンク] - 渡邊 昌「低タンパク質加工玄米の腎不全予防」(大坪研一監修『米の機能性食品化と新規利用技術・高度加工技術の開発』〈pp.245-258〉エヌ・ティーエス)(2023年)
